Nombre del producto:Metiletilcetona
Formato molecular:C4H8O
N.º CAS:78-93-3
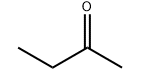
Estructura molecular del producto:
Especificación:
| Artículo | Unidad | Valor |
| Pureza | % | 99,8 minutos |
| Color | APHA | 8máx. |
| Valor ácido (como ácido acetato) | % | 0.002máx. |
| humedad | % | 0.03máx. |
| Apariencia | - | Líquido incoloro |
Propiedades químicas:
La metil etil cetona es susceptible a diversas reacciones debido a su grupo carbonilo y al hidrógeno activo adyacente a este. La condensación ocurre al calentarse con ácido clorhídrico o hidróxido de sodio para producir 3,4-dimetil-3-hexen-2-ona o 3-metil-3-hepten-5-ona. Al exponerse a la luz solar durante un tiempo prolongado, se producen etano, ácido acético y productos de condensación. Genera diacetilo al oxidarse con ácido nítrico. Al oxidarse con agentes oxidantes fuertes como el ácido crómico, se genera ácido acético. La butanona es relativamente estable al calor, y la escisión térmica a temperaturas más altas produce enona o metil enona. Al condensarse con aldehídos alifáticos o aromáticos, se producen cetonas de alto peso molecular, compuestos cíclicos, condensación de cetonas y resinas. Por ejemplo, la condensación con formaldehído en presencia de hidróxido de sodio produce primero 2-metil-1-butanol-3-ona, seguida de deshidratación a metacrilatona.
La resinización se produce por exposición a la luz solar o ultravioleta. La condensación con fenol produce 2,2-bis(4-hidroxifenil)butano. Reacciona con ésteres alifáticos en presencia de un catalizador básico para producir β-dicetonas. La acilación con anhídrido ácido en presencia de un catalizador ácido para formar β-dicetonas. Reacciona con cianuro de hidrógeno para formar cianhidrina. Reacciona con amoníaco para formar derivados de cetopiperidina. El átomo de hidrógeno α de la butanona se sustituye fácilmente con halógenos para formar diversas cetonas halogenadas, como la 3-cloro-2-butanona, por interacción con cloro. La interacción con 2,4-dinitrofenilhidrazina produce 2,4-dinitrofenilhidrazona amarilla.
Solicitud:
La metil etil cetona (2-butanona, etil metil cetona, metil acetona) es un disolvente orgánico de baja toxicidad, presente en numerosas aplicaciones. Se utiliza en productos industriales y comerciales como disolvente para adhesivos, pinturas y productos de limpieza, y como desparafinador. Componente natural de algunos alimentos, la metil etil cetona puede liberarse al medio ambiente a causa de volcanes e incendios forestales. Se utiliza en la fabricación de pólvora sin humo y resinas sintéticas incoloras, como disolvente y en recubrimientos de superficies. También se utiliza como aromatizante en alimentos.
El MEK se utiliza como disolvente en diversos sistemas de recubrimiento, como vinilo, adhesivos, nitrocelulosa y recubrimientos acrílicos. Se utiliza en decapantes, lacas, barnices, pinturas en aerosol, selladores, pegamentos, cintas magnéticas, tintas de impresión, resinas, colofonias, soluciones de limpieza y para la polimerización. Se encuentra en otros productos de consumo, como cementos para el hogar y el bricolaje, y productos para relleno de madera. El MEK se utiliza en la desparafinación de aceites lubricantes, el desengrasado de metales, en la producción de cueros sintéticos, papel transparente y papel de aluminio, y como intermedio químico y catalizador. Es un disolvente de extracción en el procesamiento de alimentos e ingredientes alimentarios. El MEK también se puede utilizar para esterilizar equipos quirúrgicos y dentales.
Además de su fabricación, las fuentes ambientales de MEK incluyen los gases de escape de los motores a reacción y de combustión interna, y actividades industriales como la gasificación del carbón. Se encuentra en cantidades sustanciales en el humo del tabaco. El MEK se produce biológicamente y se ha identificado como un producto del metabolismo microbiano. También se ha encontrado en plantas, feromonas de insectos y tejidos animales, y es probable que el MEK sea un producto menor del metabolismo normal de los mamíferos. Es estable en condiciones normales, pero puede formar peróxidos con el almacenamiento prolongado; estos pueden ser explosivos.
Categorías de productos
-

Teléfono
-

Correo electrónico
-

WhatsApp
-

Arriba













